Biosimilárne lieky v STADA – Skúsenosti a inovácie
Starostlivosť o ľudské zdravie je pre STADA stredobodom pozornosti. Vo svetle čoraz väčšieho dopytu po dostupnejších a účinnejších metódach biologickej liečby preto s potešením predstavujeme dynamicky sa rozširujúce portfólio vysoko kvalitných špecializovaných biosimilárnych liečiv.
Naše biosimilárne lieky zjednodušujú prístup k liečbe pre pacientov s rozličnými diagnózami.
Biosimilárne lieky sa v Európe tešia všeobecnej dôvere už takmer 20 rokov, od prvého európskeho schválenia biosimilárnych liečiv v roku 20061. Odvtedy poskytli biosimilárne lieky európskym pacientom takmer 4,5 miliardy dní liečby. Dnes máme v portfóliu viacero biosimilárnych liekov a na mnohých ďalších pracujeme.
Čo sú biosimilárne lieky?
Biosimilárny liek je biologické liečivo, ktoré sa veľmi podobá na iné biologikum:1
Biosimilárne lieky sa schvaľujú prostredníctvom rovnako prísnych noriem na kvalitu, bezpečnosť a účinnosť, ako akékoľvek iné liečivá:1
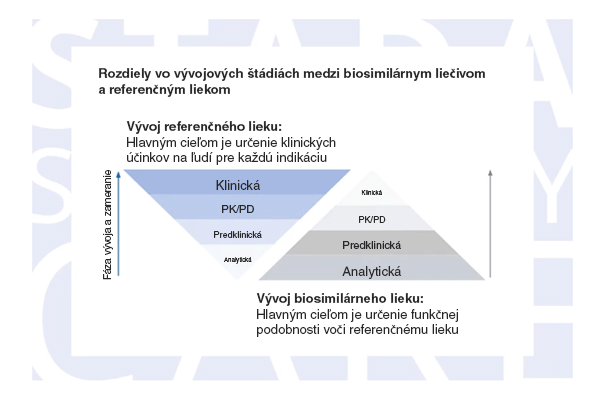
Vývoj biosimilárnych liečiv
Pred uvedením na trh musí biologikum prejsť komplexným vývojom.2 Vývoj biologických liekov je komparatívny a pozostáva z oddelených na seba nadväzujúcich fáz. Po rozsiahlych analytických a neklinických štúdiách sa vykoná komparatívna klinická štúdia, v rámci ktorej sa určí kvalita, bezpečnosť a účinnosť referenčného a biosimilárneho lieku.
Vďaka tomuto programu sa môže biosimilár spoľahnúť na výsledky klinických testov referenčného liečiva a vyhnúť sa tak zbytočnej duplicite.1 Tento postup urýchľuje proces vývoja o 1 až 3 roky a pomáha znížiť náklady na vývoj o 500 až 700 miliónov dolárov, takže výsledný produkt môže byť pre pacientov oveľa dostupnejší.
Výrobcovia biosimilárnych liečiv sú povinní prostredníctvom rozsiahlych komparatívnych štúdií s referenčnými liečivami dokázať, že:
- ich biosimilárne lieky vykazujú zásadnú podobnosť s referenčným liečivom, bez ohľadu na prirodzenú variabilitu prítomnú vo všetkých biologických liekoch,
- medzi biosimilárnym a referenčným liečivom neexistujú žiadne klinicky významné rozdiely z hľadiska kvality, bezpečnosti, účinnosti a imunogenézy.
Drobné rozdiely medzi biosimilárnymi liečivami a ich referenčnými liečivami nemajú vplyv na hlavné ukazovatele kvality.
Kompatibilita s referenčným liečivom
Dôkladne kontrolovaný proces výroby zabezpečuje, že biosimilárny liek vykazuje vysoký stupeň podobnosti na referenčné liečivo. Ako pri každom inovatívnom farmaceutickom výrobku, aj pri biosimilárnych liekoch sa pri vývoji musí klásť dôraz na hlavné kvalitatívne ukazovatele a kľúčové faktory, ktoré môžu mať klinicky závažné dôsledky.
Súbor vybraných vlastností, ktoré sa nazývajú hlavné kvalitatívne vlastnosti, môže mať priamy vplyv na kvalitu, bezpečnosť a účinnosti biosimilárneho lieku.3
Európska lieková agentúra (EMA) a Sieť riaditeľov liekových agentúr (HMA) celonárodne zdôraznili, že biosimilárne lieky schválené v EÚ sú z vedeckého hľadiska zameniteľné4, takže je možné ich používať namiesto referenčných liečiv (alebo naopak), alebo namiesto iných biosimilárov založených na rovnakom referenčnom liečive.
Názvoslovie: biosimilárny a referenčný liek obsahujú rovnakú aktívnu zložku, preto majú v rámci Európy rovnaký medzinárodný nechránený názov (INN). Líšia sa však obchodným názvom.
Extrapolácia
Extrapolácia indikácií pre biosimiláry je založená na profile referenčného lieku.1

Všetky dôkazy svedčia o tom, že molekula biosimilárneho lieku je zhodná s referenčným liečivom.1,5 Môžeme preto predpokladať, že biosimilár sa bude správať rovnako ako molekula referenčného lieku pri všetkých indikáciách a skupinách pacientov.4
Po potvrdení biologickej podobnosti môže byť biosimilárne liečivo schválené pre všetky indikácie referenčného liečiva bez potreby vykonania dodatočných klinických skúšok.1,4
Tento proces sa nevyužíva len pri biosimilároch. Už dlhé roky sa uplatňuje aj pri referenčných liečivách, ktoré prešli zmenou výrobného procesu.
Nahraditeľnosť a zameniteľnosť
19. septembra 2022 vydali EMA a HMA na základe vedeckých poznatkov spoločné tlačové vyhlásenie podporujúce zameniteľnosť biosimilárnych liečiv v rámci EÚ. Biosimiláry schválené v EÚ a príslušné referenčné liečivá sú navzájom voľne zameniteľné, rovnako ako rôzne druhy biosimilárnych liekov odvodených od toho istého referenčného liečiva.4
Aké sú výhody biosimilárnych liečiv?
Podľa Európskej agentúry pre lieky, ktorá posudzuje a reguluje biologické lieky v EÚ, „biologická konkurencia by mala zlepšiť prístup pacientov k bezpečným a účinným biologickým liekom s preukázanou kvalitou.“7
Biela kniha od rešpektovaného inštitútu pre výskum trhu IQVIA ukazuje, že biosimilárna súťaž v Európe o 18 biologických molekúl vytvorila kumulatívne úspory za katalógové ceny vo výške viac ako 30 miliárd EUR8. Biosimilárne lieky poskytli európskym pacientom takmer 4,5 miliardy dní liečby vrátane približne 850 miliónov dní liečenia len v roku 2022.
Vďaka zlepšenej hodnote, ktorú poskytuje konkurencia biosimilárnych liekov, môže byť viac pacientov liečených biologickými liekmi za rovnaké alebo dokonca znížené náklady. Potvrdila to nedávna analýza biosimilárnej konkurencie na európskych trhoch s inhibítormi TNF-alfa, ktorá zistila, že vstup biosimilnej konkurencie na trh zvýšil využitie infliximabu, etanerceptu a adalimumabu v priemere o 88,9 %, 14,6 % a 22,4 %. .9
Napríklad dôkazy z reálneho sveta z Poľska preukázali potenciál na rozšírenie prístupu pacientov k inhibítorom TNF-alfa, ako sú adalimumab, infliximab a etanercept, vďaka úsporám nákladov, ktoré vznikajú vďaka biosimilárnej konkurencii. Táto analýza vypočítala odhadované celkové úspory vo výške viac ako 243 miliónov EUR za inhibítory TNF-alfa, pričom celkové zníženie priemerných ročných nákladov na liečbu sa pohybovalo medzi 75 % a 89 %. Ak by sa všetky úspory v rozpočte vynaložili na úhradu dodatočných inhibítorov TNF-alfa, v roku 2021 by sa hypoteticky mohlo liečiť takmer 45 000 pacientov s reumatickými ochoreniami pohybového ústrojenstva.
Referencie
1 European Medicines Agency (EMA). Biosimilars in the EU. Information guide for healthcare professionals. 2019. Available at: https://www.ema.europa.eu/en/documents/leaflet/biosimilars-eu-information-guide-healthcare-professionals_en.pdf. Last accessed March 2023.
2 Biosimilar Medicines Group. Biosimilar Medicines Handbook. 3rd edition 2016. Available at: https://www.medicinesforeurope.com/wp-content/uploads/2016/04/BIOSIMILAR-MEDICINES-HANDBOOK_INT_web_links2.pdf. Last accessed March 2023.
3 Vulto AG and Jaquez OA. Rheumatology (Oxford). 2017; 56 (suppl_4): iv14-iv29.
4 European Medicines Agency (EMA and European Commission): Statement on the scientific rationale supporting interchangeability of biosimilar medicines in the EU; April 2023. Available at: https://www.ema.europa.eu/en/documents/public-statement/statement-scientific-rationale-supporting-interchangeability-biosimilar-medicines-eu_en.pdf
5 Hobbs AL, Crawford JP. Pharm Pract (Granada). 2019;17(3):1659.
6 Cegfila® SmPC (Feb. 2023).
7 Biosimilar medicines: Overview | European Medicines Agency (europa.eu).
8 https://www.iqvia.com/library/white-papers/the-impact-of-biosimilar-competition-in-europe-2022.
10 Budget impact analysis and treatment availability with biosimilar TNF inhibitors in rheumatic diseases in Poland: real-world evidence using a nationwide database | Annals of the Rheumatic Diseases (bmj.com).












